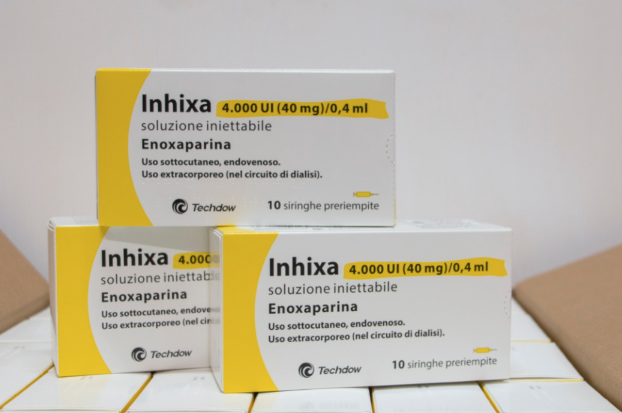
Milano, 9 aprile 2020 – L’Agenzia Italiana del Farmaco (AIFA) ha autorizzato oggi l’avvio dello studio multicentrico INHIXACOVID19, che prevede l’impiego del biosimilare di enoxaparina sodica (Inhixa®) nel trattamento dei pazienti con quadro clinico moderato o severo. La sperimentazione valuterà la sicurezza e l’efficacia dell’anticoagulante, somministrato a diversi dosaggi, nel migliorare il decorso della malattia. Ai 14 centri italiani coinvolti nello studio[1] il farmaco sarà fornito gratuitamente dall’azienda Techdow Pharma, filiale italiana della Shenzhen Hepalink Pharmaceutical Group.
Enoxaparina sodica è un’eparina a basso peso molecolare con un’elevata azione antitrombotica che ne fa, ad oggi, uno degli anticoagulanti più utilizzati per la prevenzione e la terapia delle tromboembolie venose (TEV) e arteriose nei soggetti sottoposti a intervento chirurgico o allettati.
Tutti i 300 pazienti ammessi alla sperimentazione riceveranno enoxaparina biosimilare per via sottocutanea (Inhixa® ) in mono-somministrazione giornaliera: un gruppo di 100 pazienti con dose di profilassi pari a 4.000 U.I. e un gruppo di 200 con dosi terapeutiche intermedie di 6.000, 8.000 o 10.000 U.I., in base alla massa corporea. Lo studio sarà coordinato dal professor Pierluigi Viale, Ordinario di Malattie Infettive dell’Università di Bologna e Direttore dell’Unità Operativa Malattie Infettive del Policlinico Sant’Orsola-Malpighi. Il protocollo della sperimentazione è stato presentato all’AIFA da un gruppo di lavoro composto anche da Benilde Cosmi, Maddalena Giannella, Maria Carla Re, Filippo Drago, Andrea Stella e Li Li.
Le alterazioni della coagulazione e le complicazioni trombotiche nei pazienti Covid-19 hanno un ruolo significativo in termini di incidenza e di rilevanza clinica, rappresentando una delle più importanti variabili associate a mortalità. Non a caso, già lo scorso gennaio, l’Organizzazione Mondiale della Sanità[2] ha raccomandato di prevenire il tromboembolismo venoso nei soggetti infetti da SARS-CoV-2 ricorrendo alla somministrazione sottocute di eparina, preferibilmente a basso peso molecolare. L’insorgenza di eventi trombotici nei pazienti Covid-19 anche in corso di profilassi alla dose standard di 4.000 U.I. dimostra tuttavia come tale dosaggio non metta sempre al riparo dalle complicanze. Alla luce delle evidenze scientifiche raccolte finora e dei risultati incoraggianti che provengono dagli studi svolti in Cina, sia in vitro sia sui pazienti, è nata l’idea di promuovere una sperimentazione anche in Italia impiegando, a scopo terapeutico, un dosaggio medio-alto del farmaco.
I dati che giungono dall’Oriente suggeriscono un ruolo di Inhixa® nel limitare l’azione patogena del virus . L’eparina ha una struttura molto simile all’eparan solfato, molecola presente sulla superficie cellulare del nostro organismo e usata dal SARS-CoV-2 per aderire alla cellula, prima di entrarvi e liberare all’interno sostanze tossiche chiamate citochine. L’anticoagulante attrae il virus che si attacca alla molecola del farmaco: il virus viene così “ingannato” e, anziché aggredire le cellule sane, aggredisce l’eparina.
A conferma di ciò, i test cinesi effettuati da Techdow mostrano in vitro l’efficacia antivirale di Inhixa®,associata alla capacità di interferire altresì con la “tempesta citochinica” che caratterizza la fase iper-infiammatoria della malattia, che è quella più pericolosa per il paziente.
“Un altro importante tassello del nostro armamentario terapeutico verso Covid-19 entra nella fase di sperimentazione clinica, quanto mai necessaria per capirne al meglio il ruolo e l’applicabilità”, dichiara il professor Pierluigi Viale, coordinatore dello studio. “Siamo grati ad AIFA per questa celere approvazione, che consentirà ai centri coinvolti di iniziare a lavorare per dimostrare il razionale di questa ipotesi scientifica. Abbiamo necessità di acquisire rapidamente evidenze e pertanto dobbiamo lavorare all’interno di trial clinici, associando alle nostre intuizioni e speranze il necessario rigore metodologico”.
“La terapia dell’infezione da COVID-19 con enoxaparina ha una solida base scientifica e un razionale dimostrato con prove precliniche e studi preliminari sull’uomo”, commenta il professor Filippo Drago, Direttore dell’Unità Operativa di Farmacologia Clinica presso l’AOU Policlinico Vittorio Emanuele di Catania. “A differenza di altri farmaci utilizzati in off-label, enoxaparina presenta un rapporto beneficio/rischio comunque favorevole poiché la sua efficacia contro i fenomeni tromboembolici in questi pazienti è superiore agli eventuali effetti avversi. Infine, l’uso di enoxaparina è fortemente consigliato in pazienti Covid-19 che assumono antiretrovirali, per l’elevato rischio emorragico derivante dalla loro interazione con farmaci anticoagulanti orali (NAO)”.
[1] Azienda Ospedaliero-Universitaria Sant’Orsola-Malpighi di Bologna, Azienda Ospedaliero-Universitaria di Parma, Azienda Ospedaliero-Universitaria Policlinico V. Emanuele di Catania, ASST Spedali Civili di Brescia, Fondazione Poliambulanza di Brescia, Azienda Ospedaliero-Universitaria Integrata di Verona, Ospedale Amedeo di Savoia di Torino, Azienda Ospedaliera San Carlo di Potenza, Unità Operativa Complessa Malattie infettive di Rimini e Forlì/Cesena dell’Ausl Romagna, Policlinico di Modena, IRCCS Casa Sollievo della Sofferenza di San Giovanni Rotondo (FG), Ospedale San Raffaele di Milano, ASST Cremona, Policlinico Universitario Gemelli di Roma.
[2] WHO, “Clinical management of severe acute respiratory infection when novel coronavirus (2019-nCoV) infection is suspected. Interim guidance”, 28 January 2020, https://www.who.int/publications-detail/clinical-management-of-severe-acute-respiratory-infection-when-novel-coronavirus-(ncov)-infection-is-suspected.